About Our Research.
We are interested in the biological significance of post-translational protein modifications in human diseases. Abnormal protein modifications have been documented in many human diseases such as Alzheimer’s disease. However, current knowledge remains limited to the causal relationship and contributions of protein modifications to a disease progression.
Using the state-of-the-art technology in biochemistry, functional genomics/proteomics, and chemical biology, we are developing new tools (For example: PhosTAC7 and EGFR-PhosTAC) and methods such as PROTACs, PhosTACs (Ref: ACS Chem Bio, 2021 、JACS, 2023 and Science Advances, 2024) and related bifunctional molecules that enable us to understand the contribution of protein modifications (including phosphorylation, glycosylation and ubiquitination, etc.) to a targeted protein function and its disease relevance.
Interested in our work? We are actively recruiting lab members. We also welcome research collaborations from all aspects related to PTM and human diseases. Please let us know!!!
我們的研究主要聚焦在與人體疾病相關的蛋白質修飾。許多人類疾病已經發現與不正常的蛋白質修飾相關,例如阿茲罕默症,然而,我們對於這些不正常的蛋白質修飾與疾病的關聯性仍有許多未知。搭配生物化學/基因體學/蛋白質體學及化學生物學等領域最新的生物技術,我們將研發新的工具 (例如:PhosTAC7、EGFR-PhosTAC)及方法,例如PROTACs, PhosTACs (參考文獻: ACS Chem Bio, 2021 、 JACS, 2023、Science Advances, 2024) 及相關的雙功能分子,讓我們能更了解不同蛋白質修飾對單一特定蛋白之功能的影響及其與疾病的關聯性。對我們的研究有興趣嗎?我們正在積極招募新成員, 我們也非常歡迎各個領域的可能合作對象,請讓我們知道你的聲音!
<科學新知> 什麼是PROTAC?
PROTAC的英文全名為proteolysis targeting chimera,中文意即標靶蛋白質降解嵌合體,這是一種化學分子的嵌合體(或稱雙功能分子bifunctional molecules、雙特異性分子dual-specific molecules)。此嵌合體分子的一端可與標的蛋白質產生化學連結,而另一端可與E3泛素連接酶連結,如此可拉近(induced proximity)細胞內標的蛋白質與E3泛素連接酶的距離,進而催化標的蛋白質的泛素化,泛素化的蛋白質即會被細胞內的蛋白質降解體(proteasome)辨認並且降解,以達到清除標的蛋白質的效果。PROTAC具有許多與傳統小分子藥物不同的特性,例如:PROTAC同時針對兩種蛋白質作用以達到生物效果、PROTAC與蛋白質的結合不需要具有太高的化學親和力、PROTAC不需要結合標的蛋白質的活性位置,亦即可以針對傳統認為無法標靶的蛋白質、PROTAC會把蛋白質清除而非僅抑制活性、PROTAC分子可以再被循環利用以降解更多蛋白質等,此項科技不同於可編輯或移除特定DNA的CRISPR或影響mRNA轉譯或降解的siRNA,PROTAC科技可以口服藥的方式針對特定蛋白質泛素化,並減少特定蛋白質於細胞內或外的表現,以達到預期的生物效果。
PROTAC這項新穎科技的概念最早在2001年,由美國耶魯大學的Craig M. Crews教授以及美國加州理學院的Raymond J. Deshaies教授的研究團隊所共同提出(1),然而重要的突破大約在2010-2015年間找到兩個E3泛素連接酶的配體(ligand)(2-3)。這兩個配體分別為IMiDs (Thalidomide/Pomalidomide/Lenalidomide/etc)可以結合cereblon (CRBN)並利用CRBN-CUL4系統誘導標的蛋白質泛素化及降解,另一個則為可結合至Von Hippel-Lindau (VHL)的小分子,利用VHL-CUL2系統誘導標的蛋白質泛素化及降解,這兩個系統奠定PROTAC的基礎並已經由多個實驗室、藥物開發公司及國際級大藥廠證實可以有效的降解許多疾病相關的蛋白質,經過20年的研發,近期已經有領先藥物分別進入美國臨床一至三期試驗,例如ARVINAS的ARV-110(雄性賀爾蒙受體降解藥,可應用於攝護腺癌)或ARV-471(雌性賀爾蒙受體降解藥,可應用於乳癌)等,這一類的相關藥物未來於臨床藥物市場應用的可能性相當高(4-5)。
台灣有PROTAC相關的研發嗎?有喔!PROTAC於臨床應用潛力近些年也吸引了許多學術單位或民間企業,比如工研院、財團法人生技中心、國衛院、中研院、台大、成大等機構都有發展,想要進一步瞭解更多的PROTAC發展嗎?成大醫學院生化所及基醫所開設的相關課程都有PROTAC的足跡,博士後研究訓練於耶魯Craig Crews教授實驗室的陳伯翰老師非常歡迎有興趣的同學及研究同仁選修、旁聽!對PROTAC相關研究有興趣嗎?歡迎來信pohanchenbmb@gs.ncku.edu.tw,也非常歡迎加入我們的實驗室!
參考文獻:
1. Sakamoto et al., PNAS, 2001. (link)
2. Lu et al., Chemistry&Biology, 2015. (link)
3. Buckley et al., JACS, 2012. (link)
4. Laramy et al., NatRevDrugDis, 2023. (link)
5.Chirnomas et al., NatRevClinOnc, 2023. (link)
<科學新知>什麼是PhosTAC?—updated 03/29/2024
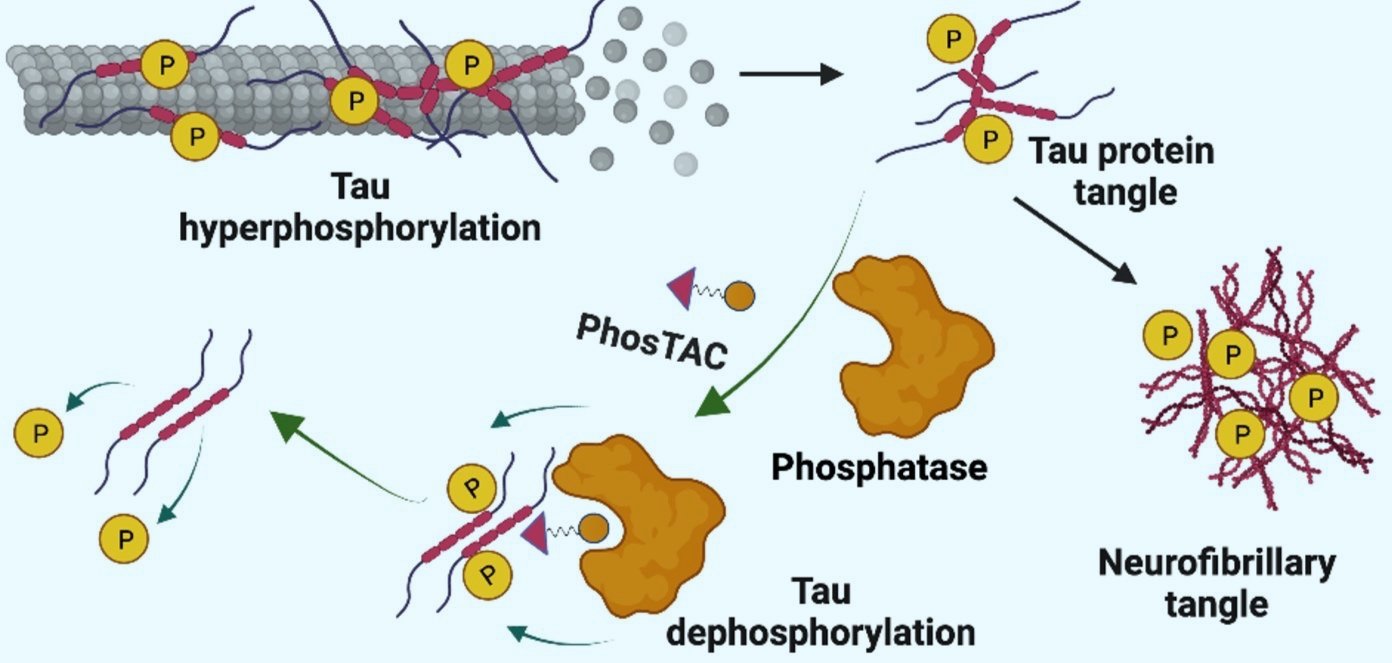
延續PROTAC的概念,我們認為雙功能(或雙特異性)分子的其中一端所結合的蛋白質功能或特性將可決定另一端標的蛋白 質的宿命,於是我們想知道類似的科技是否可以應用於泛素化以外的蛋白質轉譯後修飾(蛋白質的轉譯後修飾可以改變蛋白質的功能或性質)。在所有蛋白質轉譯後修飾中,被文獻記載最多就屬蛋白質磷酸化,蛋白質的磷酸化由蛋白質激酶(protein kinase)及蛋白質去磷酸酶(protein phosphatase)所調控,此調控根據每個蛋白質的特性及工作時間而有動態的平衡,蛋白質磷酸化可以決定蛋白質在細胞內的位置、半衰期、活性、交互作用的分子等等,特定的蛋白質磷酸化也會決定細胞分化、分裂等基礎功能,而不正常的蛋白質磷酸化也常見於許多人類疾病例如癌症,儘管科學家們已經找出可以調控某些蛋白質磷酸化的小分子激脢抑制劑(kinase inhibitor),但是並非在相關疾病都找得到具高度專一性及有效性的激脢抑制劑,因此我們希望透過PROTAC的概念找到新的調控蛋白質磷酸化的方式。
PhosTAC的英文全名為phosphorylation targeting chimera,意即磷酸化標靶嵌合體,相較於PROTAC利用E3泛素連接酶促進蛋白質泛素化,PhosTAC的概念是利用拉攏細胞內原有的蛋白質去磷酸酶至某蛋白質周圍,以達到某蛋白質去磷酸化的功能。這個方式不同於蛋白質抑制劑直接抑制上游蛋白質激酶,而是利用細胞內原有的負向調控機制強迫過度磷酸化的蛋白質去磷酸化,最早的研究由Genentech的團隊提出的PhoRC (phosphatase recruitment chimera)利用protein phosphatase 1(PP1)已減少Akt或EGFR的磷酸化(1),而後由陳伯翰博士(現成功大學助理教授)及胡振一博士(現中國科學院研究員)於耶魯的Crews團隊所提出的PhosTAC概念藉由拉攏protein phosphatase 2 A (PP2A) 或PTPN2強迫FOXO3A、PDCD4、Tau及EGFR等蛋白質去磷酸化(2-4),除了這兩個團隊以外,Prof. Lei Wang提出的PP5-recruiting PHORC (5)、Prof. Jian-Zhi Wang所提出的tau-DEPTAC (6)及Prof. Sapkota提出的Affinity-directed phosphatase (7)也都有非常棒的去磷酸化研究,建議有興趣的研究同仁參閱這些新世代的科技發展!
對PhosTAC有興趣嗎?陳伯翰老師的團隊正致力於新一代PhosTAC的研發,我們希望拉攏建立不同領域的跨國研究團隊,也歡迎業界的產學合作,非常期待有興趣的同仁來信詢問!
參考文獻:
Yamazoe et al., J. Med. Chem., 2020. (link)
Chen and Hu et al., ACS. Chem. Bio., 2021. (link)
Hu and Chen et al., J.A.C.S., 2023. (link)
Hu and Chen et al., Science Advances, 2024 (link)
Zhang et al., J.A.C.S., 2023. (link)
Zheng and Tian et al., Sig. Trans. Tar. Ther., 2021. (link)
Simpson and Flucher et al., Cell Chem. Bio., 2023. (link)